Zusammenfassung Legionellen und Pseudomonaden können technische Wassersysteme besiedeln und sind in der Lage, schwerwiegende Infektionen wie Pneumonien hervorzurufen. Vernebelungssysteme zur Bewässerung von Pflanzen in Gewächshäusern erzeugen ein feines Aerosol und könnten damit Auslöser von bakteriellen Infektionen sein. Die vorliegende Studie untersucht die Besiedlung dieser Gewächshaus-Vernebelungssysteme mit den erwähnten Bakterien und bewertet die gefundenen Ergebnisse. Insgesamt wurden 80 Wasserproben aus 20 verschiedenen Vernebelungssystemen untersucht, die jeweils in zwei Durchgängen beprobt worden sind. Bei jeder Probenahme wurde jeweils Wasser aus dem zentralen System und peripher an den Vernebelungsdüsen entnommen. Legionella spp. konnte in 10% der Wassersysteme (2 Systeme) nachgewiesen werden, allerdings nur in relativ geringen Keimzahlen von 60 KBE/l bzw. 350 KBE/l. Im Gegensatz dazu wurde Pseudomonas spp. in 70% der Gewächshaus-Bewässerungssystemen (14 Systeme) gefunden, teilweise in Keimzahlen von mehr als 10.000 KBE/100 ml. Durch Typisierung mit einer RAPD PCR-Methode konnte gezeigt werden, dass jedes kolonisierte Gewächshaus einen individuellen Stamm oder mehrere jeweils individuelle Stämme von Legionellen bzw. Pseudomonaden hatte. In einigen Fällen war der in den Kontrollproben gefundene Pseudomonasstamm identisch mit denen der ersten Isolierung. Die Studie hat gezeigt, dass Gewächshaus-Vernebelungssysteme mit Legionella spp. und Pseudomonas spp. besiedelt sein können und diese unter ungünstigen Bedingungen ein Infektionsrisiko für Gärtner und Besucher darstellen können. Schlüsselwörter: Gewächshäuser, Vernebelungssysteme, Legionellen, Pseudomonaden, Typisierung. Colonisation of greenhouse misting systems by Legionella spp. and Pseudomonas spp. Abstract Greenhouse misting systems used for watering plants produce fine aerosols and are a potential cause for bacterial infections. This study investigates the colonization of greenhouse misting systems with Legionella spp. and Pseudomonas spp. and evaluates a possible health hazard. A total of 80 water samples were collected in 20 different greenhouse systems in Germany, each tested on two different occasions. Each time, water was drawn at a central tap and at the outlet of spray nozzles. Legionella spp. were detected in 10% of the systems (two systems), but only in low numbers. On the contrary, Pseudomonas spp. were recovered from 70% of the greenhouse watering systems (14 systems), occasionally at counts greater than 10.000 CFU per 100 ml. A random amplified polymorphic DNA polymerase chain reaction typing method was used to demonstrate that each colonized greenhouse had one or several individual strains of Legionella and Pseudomonas that could not be detected in any other system. This study indicates that aerosolizing greenhouse watering systems may be contaminated with Legionella or Pseudomonas which under certain circumstances could become a potential source of infection for workers and visitors. Keywords: greenhouse, misting systems, Legionella, Pseudomonas, typing.
1. Einleitung
Legionella pneumophila wurde im Jahre 1977 als Erreger der Legionärskrankheit anlässlich eines Krankheitsausbruches bei einem Veteranentreffen der American Legion in Philadelphia (USA) isoliert. Darauf folgend wurden zahlreiche weitere Legionellenarten sowie verschiedene Serogruppen entdeckt. Die durch Legionella spp. ausgelösten Krankheiten umfassen eine akute pneumonische Form (Legionärskrankheit) und eine der Influenza ähnliche namens Pontiac-Fieber. Wichtige bekannte Übertragungswege sind kontaminierte Warmwasserversorgungen, Kühltürme, Whirlpools und Beatmungsgeräte 1,2,3.
Pseudomonaden sind in der Umwelt weit verbreitet und bilden Biofilme auf feuchten Oberflächen 4. Auch in Trinkwassersystemen sind sie regelmäßig nachgewiesen worden 5. Pseudomonas aeruginosa ist einer der häufigsten Erreger bei opportunistischen Infektionen des Menschen. So ist das Bakterium ein wichtiger Erreger von krankenhauserworbenen Pneumonien, besonders bei Patienten mit vorgeschädigten Atemwegen und beatmeten Patienten. Weiterhin häufig sind Wundinfektionen sowie Harnwegsinfektionen bei katheterisierten Patienten, die auch in einen septischen Verlauf übergehen können 6,7. Auch schwere chronische Infektionen wie bei Patienten mit Zystischer Fibrose kommen vor 8.
Gewächshaus-Vernebelungssysteme erzeugen ein feines Aerosol. Es ist daher prinzipiell möglich, dass diese Systeme Infektionen mit Keimen wie Legionella spp. oder Pseudomonas spp. verursachen können. In der Literatur wird bezüglich der Legionärskrankheit bisher nur über den Fall eines Gewächshausarbeiters berichtet, der sich bei der Arbeit wahrscheinlich mit einem Stamm von Legionella longbeachae infiziert hat. Aufgrund fehlender Isolate konnte aber keine eindeutige infektionsepidemiologische Verbindung zum Gewächshaus hergestellt werden 9. Weiterhin gibt es eine Nachrichtenmeldung, dass im Jahr 2002 ein Restaurant mit einem Verneblungssystem als Teil einer Regenwalddekoration die Infektionsquelle für einen Pontiac-Fieberausbruch in den USA war 10. Allerdings scheint nie ein Bericht von den zuständigen Behörden oder einer anderen Stelle zu diesem Fall veröffentlicht worden zu sein.
Die vorliegende Studie untersucht die Besiedlung dieser Vernebelungssysteme in Gewächshäusern mit den genannten Bakterien und bewertet die gefundenen Ergebnisse.
2. Material und Methoden
Die Wasserproben sind aus Vernebelungssystemen von privaten und öffentlichen Gewächshäusern in Niedersachsen und Hessen zwischen Juni und September 2003 entnommen worden. Die untersuchten Gewächshäuser wurden zur Kultivierung von Pflanzen und Bäumen für den Gartenbau, die Forschung oder als Schaugewächshäuser für die Öffentlichkeit genutzt. Einige Anlagen wurden zur Haltung unter tropischen Bedingungen betrieben. Insgesamt sind 20 verschiedene Vernebelungsanlagen in zwei Durchgängen untersucht worden. Wasser wurde dabei jeweils an den Vernebelungsdüsen und einem Hahn am zentralen System hinter dem Wasserzulauf (in einigen Fällen aus den internen Wassertanks) entnommen. Die Proben wurden ohne Ablaufen Lassen des Wassers entnommen; nur bei den zentralen Hähnen wurde das Wasser aus dem Zulaufrohr verworfen. Gespeist wurden die Gewächshausvernebelungssysteme durch Wasser aus der öffentlichen Trinkwasserversorgung (Gewächshaus A [entionisiert], B, C, D [Durchgang 1 System im Bau; Durchgang 2 entionisiert], H, I, J, L [Enthärtung], M, P, Q, S, T), aus Regenwasserzisternen (Gewächshaus E, F, N, R), aus privaten Brunnen (Gewächshaus G, K) und in einem Fall aus einem Teich (Gewächshaus O). Die Regenwasserzisternen wurden dabei jeweils bei Bedarf mit Wasser aus der öffentlichen Trinkwasserversorgung aufgefüllt.
Bakteriologische Untersuchung: Zur Kultur der Legionellen wurden die Wasserproben (jeweils 100 ml und 20 ml) durch sterile Zellulose-Mischesterfilter mittels einer Vakuumpumpe filtriert und diese anschließend für 5 min mit KCl/HCl-Säurepuffer behandelt. Die Filter wurden auf GVPC-Agarplatten für 7 Tage bei 37°C in feuchter Atmosphäre kultiviert. Parallel wurden im Doppelansatz 0,5 ml eines 1:2 Gemisches aus Probe und Säurepuffer auf GVPC-Platten direkt ausgestrichen. Verdächtige Kolonien wurden auf GVPC-Agar und Blutagar subkultiviert. Wuchsen diese nur auf GVPC-Agar, wurden sie mittels direkter Immunfluoreszenz weiteruntersucht und differenziert. Bei der Anzucht von Pseudomonaden wurden die Wasserproben (jeweils 100 ml und 20 ml) ebenfalls durch sterile Zellulose-Mischesterfilter mittels einer Vakuumpumpe filtriert und dann auf Cetrimid-Agarplatten ausgelegt. Zusätzlich wurden im Doppelansatz 0,5 ml direkt auf Cetrimid-Agarplatten ausgestrichen. Gewachsene Kolonien wurden auf ihre Fluoreszenz geprüft und repräsentative Kolonien auf Blutagar subkultiviert. Nach Untersuchung durch Gramfärbung und Oxidasetest wurden die Bakterien mit dem BBL Crystal Enteric/NF System® (Becton Dickinson) bis zur Art bestimmt. Isolate wurden jeweils bei 70°C gelagert. Weiterhin wurde die Gesamtkeimzahl entsprechend TrinkwV bei 20 und 36°C bestimmt 11.
Chemisch / physikalische Untersuchung: In jedem Durchgang wurde in den Anlagen eine Wasserprobe aus dem zentralen System zur Untersuchung auf pH-Wert, Leitfähigkeit, Gesamthärte sowie verschiedene Kationen und Anionen genommen. Weiterhin wurde der pHc-Wert errechnet 11.
Typisierung der mikrobiologischen Isolate: Zur weiteren Differenzierung der gewonnenen Isolate wurde ein PCR-Fingerprint-Verfahren (RAPD) verwendet. Für Legionellen wurden als Primer Eric2 sowie eine Kombination von Lpm 1 und Lpm 2 verwendet. Zur Typisierung der Pseudomonaden wurde der Primer 272 benutzt. Die Banden wurden durch Gelelektrophorese unter UV-Licht sichtbar gemacht (Färbung mit Ethidiumbromid). Details zur Methode finden sich in der angegebenen Literatur 11,12,13.
Die statistische Auswertung erfolgte mit den Programmen MS Excel 2000®, Winstat 2000.1® und SPSS 10.0.7®.
3. Ergebnisse
Legionellen konnten in zwei Vernebelungssystemen nachgewiesen werden (in 10 % der Anlagen), aber jeweils nur in geringen Keimzahlen. In beiden Fällen waren sie nur in jeweils einem Durchgang anzüchtbar. Beim ersten Gewächshaus (benannt K) fand sich Legionella pneumophila Serogruppe 6 in einer Keimzahl von 35 KBE / 100 ml (entsprechend 350 KBE / l) im ersten Probendurchgang vom Juli 2003 in den Proben aus den Vernebelungsdüsen (peripher). Im zweiten Fall wurde L. pneumophila Serogruppe 6 im zweiten Durchgang in zentralen Proben des Gewächshauses R in einer Keimzahl von 6 KBE / 100 ml (entsprechend 60 KBE / l) im September 2003 gefunden. Die Wassertemperaturen der positiven Proben lagen jeweils bei 21°C / 22°C. Das Vernebelungssystem von Gewächshaus K wird durch einen privaten Brunnen versorgt und das System von Gewächshaus R durch eine Regenwasserzisterne, die bei Trockenheit durch Wasser aus der öffentlichen Trinkwasserversorgung aufgefüllt wird. Insgesamt wurden 13 Isolate gewonnen. Bei der RAPD-Typisierung zeigte sich, dass jedes der beiden Gewächshäuser einen eigenen PCR-Typ aufwies und dass die Isolate aus demselben Gewächshaus jeweils identische Typen hatten 11. Im Vergleich mit Isolaten aus einer vorhergehenden Studie zu Legionellen in Gebäuden des Stadtgebietes von Göttingen ergaben sich keine übereinstimmenden Typen 11,12.
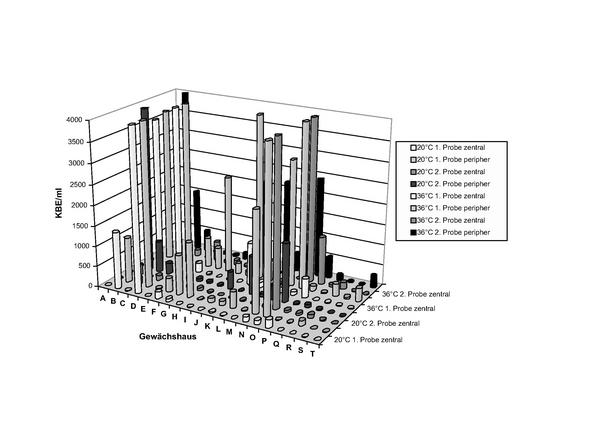
Pathogene Pseudomonaden konnten aus 70 % der Wasserproben von Vernebelungssystemen kultiviert werden (14 Anlagen), zum Teil in Keimzahlen von über 104 pro 100 ml (Abbildung 1). Mehrfach nachgewiesen werden konnten dabei die Arten P. aeruginosa, P. putida und P. fluorescens. Im Gewächshaus B konnte noch ein einzelnes Isolat von P. stutzeri festgestellt werden. Bei sieben Anlagen wurde Pseudomonas spp. sowohl in zentralen wie auch in peripheren Proben gefunden. In vier Fällen waren sie nur im zentralen Anlagenteil und in drei Fällen nur im peripheren Teil nachweisbar 11. Das Vernebelungssystem von Gewächshaus R war sowohl mit Legionellen als auch mit Pseudomonaden besiedelt. Die RAPD-Typisierung wurde für jede der drei in mehreren Isolaten gefundenen Pseudomonas-Arten getrennt durchgeführt. Jedes der fünf Gewächshäuser, in denen P. fluorescens nachgewiesen wurde, hatte seinen eigenen PCR-Typ. Ebenfalls aus Wasserproben von fünf Gewächshäusern konnte P. putida kultiviert werden. Wieder wies jedes der Gewächshäuser einen eigenen Typ auf. Die drei Isolate aus Gewächshaus M waren identisch. Bei den 59 Isolaten von P. aeruginosa ergab sich folgendes Bild: Es gab 34 verschiedene PCR-Typen. Jedes Gewächshaus mit Nachweis von P. aeruginosa hatte jeweils einen oder mehrere individuelle PCR-Typen, die in keinem anderen System nachgewiesen werden konnten. In drei Fällen konnten Isolate aus dem ersten Durchgang im zweiten Durchgang im selben Gewächshaus wieder nachgewiesen werden (Isolate von Gewächshaus H, J, P) 11.
Die Gesamtkeimzahlen bei 20 und 36°C lagen in einer Spanne zwischen 0 und größer 104 KBE/ml. Nicht selten lagen die Werte über 103 KBE/ml. Die durchschnittlichen Werte der peripheren Proben lagen dabei über denen der zentralen Proben (Abbildung 2). Gesamtkeimzahlen gelten als Teil der Gesamtbewertung für Trinkwasser.
In den Ergebnissen der chemisch-physikalischen Untersuchung spiegelte sich die Herkunft des Wassers sowie eine eventuelle Aufbereitung wieder 11.
Bei der statistischen Auswertung zeigten sich u. a. wiederholt signifikante Rangkorrelationen zwischen den Pseudomonadenzahlen und den Gesamtkeimzahlen (nur im zweiten Durchgang; p < 0,05 oder p < 0,01). 4. Diskussion Soweit uns bekannt ist, war die mögliche Kontamination von Vernebelungssystemen in Gewächshäusern mit Legionellen oder Pseudomonaden bisher nicht Gegenstand von systematischen Untersuchungen. Es wurde bisher nur eine Studie publiziert, die sich mit der Legionellen-Kontamination von Leitungswasser, Boden und Luft bei Gartenbaubetrieben im östlichen Polen beschäftigt. Bei den 20 Innenwasserhähnen in Gewächshäusern, die zur Bewässerung von Pflanzen verwendet wurden, konnte in 25,0 % der Fälle Legionella spp. nachgewiesen werden. Bei 36 zur Bewässerung verwendeten Außenwasserhähnen waren 22,2 % mit dem Bakterium besiedelt. In den Leitungswasser-, Boden- und Luftproben aus modernen Gewächshäusern gab es keinen Nachweis von Legionellen 14. Auch in Sandfiltern von Wasseraufbereitungsanlagen für die Gewächshausbewässerung sind Legionellen nachgewiesen worden 15. Legionelleninfektionen sind schon in mehreren Fallbeschreibungen mit Gartenarbeit und der Nutzung von Blumenerde in Verbindung gebracht worden 16. Im Jahr 1999 gab es auf einer Blumenschau in den Niederlanden einen Legionellenausbruch bei 188 Besuchern und Ausstellern (133 bestätigte Fälle und 55 wahrscheinliche Fälle). Als Quelle verdächtig waren eine Sprinkleranlage und zwei Whirlpools, aus deren Wasser jeweils das Bakterium kultiviert werden konnte. Bei einer eingehenden epidemiologischen Untersuchung wurde einer der Whirlpools als wahrscheinlichste Infektionsursache identifiziert 17. 4.1. Kontamination der Vernebelungssysteme mit Legionellen Die in den Vernebelungssystemen gefundenen Legionellenzahlen sind relativ gering, verglichen mit festgestellten Kontaminationen in Warmwassersystemen. So lagen die Keimzahlen bei einer Studie von Warmwassersystemen öffentlicher und privater Gebäude im Stadtgebiet von Göttingen bei bis zu 78.000 KBE/l 12. Bei den Vernebelungssystemen ergaben sich Keimzahlen von 350 bzw. 60 KBE/l. In der Studie des Stadtgebietes sind insgesamt 70 Gebäude auf Legionellen untersucht worden, von denen 26 % in mindestens einer Probe eine positive Kultur aufwiesen. Grundsätzlich waren die Wachstumsbedingungen für die Legionellen in den Vernebelungssystemen im Vergleich zu anderen Jahren eher günstig, da der Sommer 2003 weit überdurchschnittlich warm war. Die Lufttemperaturen lagen in den Probemonaten häufig über 25°C. Die Wassertemperaturen in den Gewächshauswassersystemen lagen in der Regel zwischen 20°C und 30°C, obwohl es teilweise einen hohen Wasserumsatz gegeben hat. Die Temperaturspanne, bei der sich Legionellen vermehren können, liegt zwischen 25°C und 42°C und einem Optimum bei 35°C 18. Ein Bewertungsschema für Legionellen-Kontaminationen in Trinkwasserversorgungsanlagen liefert das DVGW Arbeitsblatt W 551. Ab einer Keimzahl von 103 KBE/l sollte danach eine mittelfristige Sanierung erfolgen. Werte über 105 KBE/l werden als extrem hohe Kontamination eingestuft, die eine sofortige Expositionsprophylaxe sowie Desinfektions- und Sanierungsmaßnahmen erforderlich machen 19. Die Schwellenwerte sind technischer Natur und beruhen nicht auf Infektionsdosisabschätzungen. Die US-amerikanische OSHA (Occupational Safety and Health Administration) empfiehlt für Befeuchter folgende Maßnahmenstufen: Bei Überschreiten einer Keimzahl von 103 KBE/l wird eine sofortige Reinigung des Systems und / oder Behandlung mit Bioziden empfohlen. Auf der nächsten Handlungsstufe 2, bei Überschreiten von 104 KBE/l, werden zusätzlich noch sofortige Maßnahmen zur Expositionsprophylaxe empfohlen. Es handelt sich hierbei um eine vorläufige Empfehlung, die auf begrenzten Daten beruht und sich nur auf die Exposition von gesunden Personen bezieht 20. Die hier in Vernebelungssystemen von Gewächshäusern gefundenen Werte von 350 bzw. 60 KBE/l liegen unter den genannten Werten, aber sie zeigen, dass die Systeme besiedelt sein können. Schließlich muss auch berücksichtigt werden, dass die Keimzahlen bei verschiedenen Messungen in derselben Anlage stark schwanken können 12. 4.2. Bewertung der Pseudomonas-Kontamination Die Vernebelungssysteme von Gewächshäusern in dieser Studie wiesen teilweise Werte von über 104 KBE / 100 ml auf. In der Tendenz hatten Proben aus dem zentralen Anlagenteil sowie Proben aus dem zweiten Durchgang höhere Werte. Verglichen mit anderen Untersuchungen an Wassersystemen erscheinen die maximalen Keimzahlen hoch bis sehr hoch 11. Allgemein werden ambulant erworbene Pneumonien mit P. aeruginosa bei zuvor gesunden Erwachsenen als selten beschrieben 21. In einer Fallbeschreibung wurde ein Befeuchter im Haushalt als Infektionsquelle einer ambulant erworbenen Pseudomonas-Pneumonie angenommen 22. In der Regel wiesen die betroffenen Patienten Vorerkrankungen oder Risikofaktoren auf. Die Verläufe dieser ambulant erworbenen Pneumonien werden dabei als überdurchschnittlich schwer beschrieben 23,24. Bei Labortests an Ratten führte eine transtracheale Infektion mit 106 KBE des P. aeruginosa Stamms PAO1 zu einer Mortalität über 50 % 25. Bei Mäusen führte eine intranasale Verabreichung der P. aeruginosa Stämme PA103 oder PA10329 zu einer dosisabhängigen Mortalität. Eine Infektion mit 104 KBE ergab keine Todesfälle, während die Verabreichung von 105 bis 106 KBE eine Mortalität von 40 % bis 80 % zur Folge hatte 26. Vergleichbare Ergebnisse ergaben sich mit P. aeruginosa Stamm AC869 ebenfalls bei Mäusen, wo 2,7 x 107 KBE zu einer Mortalität von 50 % führten 27. Nach einer Übersichtsarbeit von Rusin et al. (1997) 28 liegt die orale Infektionsdosis mit P. aeruginosa bei Tieren und auch im Test mit Versuchspersonen im Bereich von 108 und 109 KBE. Bei der Bewertung der gefundenen Keimzahlen in Vernebelungssystemen im Lichte dieser Laborergebnisse müssen verschiedene Faktoren berücksichtigt werden. Dies sind z. B. mögliche Speziesunterschiede, die Empfänglichkeit der Exponierten, Unterschiede in der Pathogenität der Stämme und in den Expositionswegen. Weiterhin spielt auch die Menge des in der Lunge abgelagerten Aerosols sowie die Teilchengröße eine wichtige Rolle. Die Teilchengröße hat dabei einen wichtigen Einfluss auf die Eindringtiefe in den Respirationstrakt. In einem groben Dosisvergleich für gesunde Personen kann man vermuten, dass auch bei einer Keimzahl von 104 KBE/100 ml noch ein gewisser Abstand zu den im Tierversuch gefundenen Infektionsdosen des respiratorischen Systems besteht. Eine belastbare Risikoabschätzung steht allerdings noch aus und bedarf weiterer Daten und Untersuchungen. Für Personen mit Vorerkrankungen oder Risikofaktoren könnte diese Abschätzung auch deutlich ungünstiger ausfallen. Zum Vergleich muss man sagen, dass die WHO für Badewasser eine Risikoabschätzung durchgeführt hat und folgende Grenzwerte empfiehlt. Bei Badebeckenwasser sollten die Pseudomonaszahlen unter 1 KBE pro 100 ml liegen (Empfehlung entspricht Wert der DIN 196431). Bei Naturbadeseen sollten die Keimzahlen unter 10/100 ml liegen. Werden Werte über 100 KBE pro 100 ml gefunden, sollte eine Überprüfung und Wartung des Systems stattfinden. Liegen die Werte dann weithin über 100 KBE/100 ml, wird eine Schließung und Sanierung / Desinfektion der Anlage empfohlen 29. Um zu einer genaueren Bewertung der gefundenen Ergebnisse kommen zu können, sind weitere Untersuchungen erforderlich. Wichtig wären hier z. B. anlagenspezifische Untersuchungen über die Luftkeimzahl und Teilchengröße im Verhältnis zur Wasserkontamination der Vernebelungssysteme. 4.3. Einschätzung der molekularen Typisierungsergebnisse Bei der Typisierung der Legionellen-Isolate (alle Serogruppe 6) hatte jedes der beiden besiedelten Gewächshäuser einen eigenen Stamm und Isolate aus demselben Gewächshaus waren jeweils identisch. In einer vorangegangenen Studie sind Warmwassersysteme in öffentlichen und privaten Gebäuden aus dem Stadtgebiet von Göttingen untersucht worden, welches einen Teil des Gebietes diese Studie an Gewächshäusern ausmacht. L. pneumophila Serogruppen 1, 4, 5 und 6 konnten aus den insgesamt 18 positiven Warmwassersystemen isoliert werden, wobei insgesamt 70 Anlagen untersucht worden waren. Die meisten kontaminierten Gebäude hatten dabei ihren eigenen PCR-Stamm. Zur Legionellen-Typisierung wurde dabei dieselbe Methode verwendet wie in dieser Studie. In drei Fällen wurde ein identischer Stamm in unterschiedlichen Gebäuden gefunden und in zwei Fällen konnten aus Anlagen zwei Serogruppen zur gleichen Zeit kultiviert werden 12. Die PCR-Typisierung der Pseudomonas-Isolate zeigte, dass jedes besiedelte Gewächshaus einen oder auch mehrere individuelle Stämme hatte, welcher in keiner zweiten Anlage wiedergefunden wurde. In drei Fällen konnte ein P. aeruginosa Stamm aus dem ersten Durchgang im zweiten Durchgang im selben Gewächshaus wiedergefunden werden. Der in dieser Typisierung eingesetzte Primer 272 zeigte bei mehreren Autoren mit P. aeruginosa gute Ergebnisse. Dies bestätigte sich an den Ergebnissen dieser Studie mit P. aeruginosa, sowie mit den beiden anderen typisierten Arten P. putida und P. fluorescens 11. Die verwendete RAPD-PCR-Methode erwies sich somit als geeignet für eine infektionsepidemiologische Ausbruchsuntersuchung sowohl von Legionellen als auch Pseudomonaden und ergab eine hohe Differenzierung der gefundenen Isolate. 5. Schlussfolgerungen Die Studie hat gezeigt, dass Gewächshausvernebelungssysteme mit Legionella spp. und Pseudomonas spp. besiedelt sein können und diese unter ungünstigen Bedingungen ein Infektionsrisiko für Gärtner und Besucher darstellen können. In Vernebelungssystemen sollten daher technische Maßnahmen getroffen werden, um die Vermehrung pathogener Bakterien zu verhindern bzw. unter Kontrolle zu halten. Weiterhin sollten die Anlagen mit in eine regelmäßige hygienisch-mikrobiologische Überwachung einbezogen werden. Danksagung Die Autoren möchten sich bei Susanne Luthin für die technische Assistenz bedanken. · 6. Literatur 01 Lück PC, Steinert M. Pathogenese, Diagnostik und Therapie der Legionella-Infektion. Bundesgesundheitsbl 2006; 49: 439 449 02Eckmanns T, Lück C, Rüden H, Weist K. Prävention nosokomialer Legionellosen. Dtsch Arztebl 2006; 103 (19): A 12941300 03Breiman RF, Butler JC. Legionnaires disease: Clinical, epidemiological, and Public Health perspectives. Sem Resp Inf 1998; 13, 8489 04Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science 1999; 284: 13181322 05Rusin PA, Rose JB, Haas CN, Gerba CP. Risk assessment of opportunistic bacterial pathogens in drinking water. Rev Environ Contam Toxicol 1997; 152: 5783 06 Sadikot RT, Blackwell TS, Christman JW, Prince AS. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med 2005; 171: 12091223 07Garau J, Gomez L. Pseudomonas aeruginosa pneumonia. Curr Opin Infect Dis 2003; 16: 135143 08Singh PK, Schaefer AL, Parsek MR, Moninger TO, Welsh MJ, Greenberg EP. Quorum-sensing signals indicate that cystic fibrosis lungs are infected with bacterial biofilms. Nature 2000; 407: 762764 09Eitrem R, Forsgren A, Nilsson C. Pneumonia and acute pancreatitis most probably caused by a Legionella longbeachae infection. Scand J Infect Dis 1987; 19: 381382 10Anonym. Legionella enews, Internet Homepage, 2002. Unter http://www.hcinfo.com/legionella_enews_020529.htm (Zugriff Juni 2006) 11Zietz B, Dunkelberg H, Ebert J, Narbe M. Isolation and characterization of Legionella spp. and Pseudomonas spp. from greenhouse misting systems. J Appl Microbiol 2006; 100: 12391250. Erratum in: J Appl Microbiol 2006; 101: 976 12Zietz B, Wiese J, Brengelmann F, Dunkelberg H. Presence of Legionellaceae in warm water supplies and identification of strains by polymerase chain reaction. Epidemiol Infect 2001; 126: 147152 13Wiese J, Helbig JH, Luck C, Meyer HG, Jansen B, Dunkelberg H. Evaluation of different primers for DNA fingerprinting of Legionella pneumophila serogroup 1 strains by polymerase chain reaction. Int J Med Microbiol 2004; 294: 401406 14Stojek NM, Dutkiewicz J. Legionella in sprinkling water as a potential occupational risk factor for gardeners. Ann Agric Environ Med 2002; 9: 261264 15Calvo-Bado LA, Morgan JA, Sergeant M, Pettitt TR, Whipps JM. Molecular characterization of Legionella populations present within slow sand filters used for fungal plant pathogen suppression in horticultural crops. Appl Environ Microbiol 2003; 69: 533541 16Anonymous. Legionnaires" Disease associated with potting soil California, Oregon, and Washington, May-June 2000. MMWR Morb Mortal Wkly Rep 2000; 49: 777778 17Den Boer JW, Yzerman EP, Schellekens J, Lettinga KD, Boshuizen HC, van Steenbergen JE, Bosman A, van den Hof S, van Vliet HA, Peeters MF, van Ketel RJ, Speelman P, Kool JL, Conyn-Van Spaendonck MA. A large outbreak of Legionnaires" disease at a flower show, the Netherlands, 1999. Emerg Infect Dis 2002; 8: 3743. Erratum in: Emerg Infect Dis 2002; 8: 180 18Fields BS, Benson RF, Besser RE. Legionella and Legionnaires" disease: 25 years of investigation. Clin Microbiol Rev 2002; 15: 506526 19Deutsche Vereinigung des Gas- und Wasserfaches e.V. (DVGW) (Hrsg. 2004). Trinkwassererwärmungs- und Trinkwasserleitungsanlagen; Technische Maßnahmen zur Verminderung des Legionellenwachstums; Planung, Errichtung, Betrieb und Sanierung von Trinkwasser-Installationen. DVGW Arbeitsblatt W 551. DVGW, Bonn, 2004 20Occupational Safety & Health Administration (OSHA) (Hrsg. 1999). OSHA Technical Manual (TED 10.15A), Section III Chapter 7, Occupational Safety & Health Administration, Washington, DC, 2006. Unter: http://www.osha.gov/dts/osta/otm/otm_iii/otm_iii_7.html (Zugriff Juni 2006) 21Hatchette TF, Gupta R, Marrie TJ. Pseudomonas aeruginosa community-acquired pneumonia in previously healthy adults: case report and review of the literature. Clin Infect Dis 2000; 31: 13491356 22Harris AA, Goodman L, Levin S. Community-acquired Pseudomonas aeruginosa pneumonia associated with the use of a home humidifier. West J Med 1984; 141: 521523 23Rello J, Bodi M, Mariscal D, Navarro M, Diaz E, Gallego M, Valles J. Microbiological testing and outcome of patients with severe community-acquired pneumonia. Chest 2003; 123: 174180 24Ramsdell J, Narsavage GL, Fink JB; American College of Chest Physicians, Home Care Network Working Group. Management of community-acquired pneumonia in the home: an American College of Chest Physicians clinical position statement. Chest 2005; 127: 17521763 25Lesprit P, Faurisson F, Join-Lambert O, Roudot-Thoraval F, Foglino M, Vissuzaine C, Carbon C. Role of the quorum-sensing system in experimental pneumonia due to Pseudomonas aeruginosa in rats. Am J Respir Crit Care Med 2003; 167: 14781482 26Schultz MJ, Rijneveld AW, Florquin S, Speelman P, van Deventer SJ, van der Poll T. Impairment of host defence by exotoxin A in Pseudomonas aeruginosa pneumonia in mice. J Med Microbiol 2001; 50: 822827 27George SE, Kohan MJ, Whitehouse DA, Creason JP, Kawanishi CY, Sherwood RL, Claxton LD. Distribution, clearance, and mortality of environmental pseudomonads in mice upon intranasal exposure. Appl Environ Microbiol 1991; 57: 24202425 28Rusin PA, Rose JB, Haas CN, Gerba CP. Risk assessment of opportunistic bacterial pathogens in drinking water. Rev Environ Contam Toxicol 1997; 152: 5783 29World Health Organization (WHO) (Hrsg. 2006). Guidelines for safe recreational waters. Volume 2 Swimming pools and similar recreational-water environments. World Health Organization, Genf, 2006. Unter: http://www.who.int/entity/water_sanitation_health/bathing/srwe2full.pdf (Zugriff Juni 2006) B. P. Zietz, M. Narbe, J. Ebert, H. Dunkelberg