Zusammenfassung Arsen wird von der WHO derzeit aufgrund einer nicht selten geogenen Kontamination von Grundwasser weltweit als die wichtigste Umweltbelastung des Trinkwassers angesehen. Neben geogenen Quellen sind die stärksten anthropogenen Emittenten Metallhütten (insbesondere Kupferhütten) und die Kohleverbrennung. Die Toxizität des Arsens ist stark von der Spezies abhängig, insbesondere die dreiwertigen Verbindungen sind hoch toxisch. Arsen und seine Verbindungen gelten als krebserregend. Tumorerkrankungen treten nach Inhalation an der Lunge und nach Ingestion an der Haut und an verschiedenen inneren Organen auf. Die Biomethylierung von anorganischem Arsen zu organischen Arsenverbindungen findet hauptsächlich in der Leber statt. Der Prozess der Biomethylierung wurde jahrelang als Detoxifizierungsprozess angesehen, neuere Forschungsergebnisse weisen jedoch darauf hin, dass es sich hierbei eher um eine Toxifizierung handelt, da besonders die dreiwertigen methylierten Arsenspezies hoch reaktiv sind. Weiterhin spielt die Membrangängigkeit der Arsenverbindungen eine wesentliche Rolle bei deren Toxizität. Diese Membrangängigkeit ist zum einen von der Arsenspezies und zum anderen von der Zellart abhängig. Erste Untersuchungen weisen darauf hin, dass Fibroblasten dreiwertige methylierte Arsenverbindungen besser aufnehmen als Urothel- und Leberzellen. Dieses Phänomen könnte für das hauptsächliche Entstehen von malignen Hautveränderungen nach Arsenexposition mit verantwortlich sein. Ein additiver Effekt von Arseneinwirkung und UV-Strahlung wird bei der Entstehung von Hauterkrankungen ebenfalls diskutiert. Die mutagene/ kanzerogene Wirkung des Arsens geht vermutlich auf indirekte zelluläre Effekte an Proteinen wie z.B. einer Hemmung der DNA-Reparatur durch Modifizierung von DNA-Reparaturproteinen zurück. Eine genomische Schädigung kann indirekt durch Einwirkung reaktiver Sauerstoffmetabolite erfolgen. In diesem Übersichtsartikel wird der aktuelle Kenntnisstand zur Wirkungsweise von anorganischem Arsen und dessen organischen Derivaten zusammenfassend dargestellt. Schlüsselwörter: Arsen, Aufnahme, Methylierung, Krebsentstehung New aspects to the arsenic induced carcinogenesis Summary Arsenic is categorised by the WHO as the most significant environmental contaminant of drinking water, due to the prevalence of geogenic contamination of groundwaters. Smelting works, in particular copper, and the burning of coal represent the greatest anthropogenic sources of arsenic. The toxicity of arsenic is extremely dependent upon the arsenic species; the trivalent arsenic species are more toxic than pentavalent. Arsenic and the compounds which it forms are considered to be carcinogenic. Tumours can develop following inhalation in the lungs, and following ingestion on the skin and various internal organs. The biomethylation of inorganic arsenic occurs mainly in the liver. The process of biomethylation was for many years regarded as a detoxification process; however more recent research has indicated that the reverse is in fact the case. Further to this, the membrane permeability of the arsenic compounds plays a significant role in their toxicity. This membrane permeability is dependent upon both the arsenic species and the cell type. Initial studies have indicated that fibroblasts are more permeable to trivalent arsenic species than are urothelial or liver cells. This phenomenon could provide an explanation why arsenic induces lesions mainly at the skin. An additive effect between arsenic and UV-exposure is also under discussion. The mutagenic/carcinogenic action of arsenic is most likely due to indirect action on proteins, for example via inhibition of DNA-repair as a result of the modification of DNA-repair proteins. Damage to the genome could occur indirectly through the action of reactive oxygen species. In this article, the current stand of the knowledge regarding the mechanisms of action of inorganic arsenic and its organic derivatives are presented and discussed. Key words: arsenic, uptake, methylation, carcinogenesis
1. Hintergrund
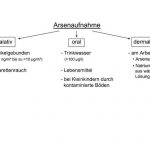
Arsen (As) ist ein weit verbreitetes Halbmetall, das in verschiedenen Sedimenten der Erdkruste vorkommt und als eines der potentesten Umweltgifte angesehen wird. Die Hauptbelastungsquelle der Bevölkerung weltweit ist die Kontamination des Grundwassers mit Arsen 1,2. Hier können regional Konzentrationen von > 100 µg/l (Spitzenwerte liegen im mg-Bereich) erreicht werden. Gebiete mit hoher Arsenbelastung sind in u.a. in Südamerika, Indien und Taiwan, aber auch in Osteuropa zu finden. Die Aufnahme von anorganischem Arsen durch Lebensmittel und bei Kleinkindern durch kontaminierte Böden wird ebenfalls beschrieben 3. In Meeresfrüchten liegt Arsen hauptsächlich als organische Verbindung (Arsenocholin, Arsenobetain) vor. Anorganisches Arsenat [As(V)] und Arsenit [As(III)] können ebenfalls an Partikel gebunden in der Außenluft vorkommen. Die Arsengehalte in der Außenluft liegen bei ca. 1 ng/m³, in Emittentennähe bei > 0,01 µg/m³ 4. Angaben zu Arsengehalten in der Luft am Arbeitsplatz streuen erheblich und können bis zu 10 µg/m³ betragen 1. Zigarettenrauchen soll eine zusätzliche inhalative Arsenbelastung bewirken 5. Eine dermale Aufnahme einzelner Arsenverbindungen ist ebenfalls möglich (z.B. Natriumarsenat in wässriger Lösung oder Arsensäure) 1 (Abb. 1).
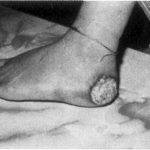
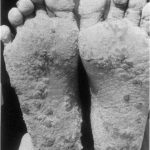
Nach der Aufnahme werden Arsenverbindungen hauptsächlich in der Leber, der Niere, der Gallenblase sowie in keratin- und sulfhydrylreichen Geweben wie Haaren, Nägeln und Haut angereichert. Zeichen einer chronischen Arsenexposition sind Hautpigmentierung, Hyperkeratose der Haut- und Fußflächen und Hautläsionen (Abb. 2, 6). Die Latenzzeit bis zur Krebsentstehung beträgt 3050 Jahre. Auf der Basis epidemiologischer Studien haben nationale und internationale Organisationen Arsen und Arsenverbindungen (mit Ausnahme von Arsenwasserstoff) als Humankanzerogen eingestuft, das Lungen-, Haut-, Blasen-, Nieren- und Lebertumore hervorrufen kann 710.
2. Die Toxizität des Arsens ist abhängig von der Biodisposition und der zellulären Aufnahme
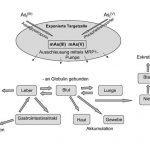
Arsen wird hauptsächlich in anorganischer Form als Arsenit (Asi(III)] oder Arsenat [Asi(V)] aufgenommen. Asi(III) ist toxischer als Asi(V), wahrscheinlich aufgrund der besseren Zellgängigkeit und der schnelleren Aufnahme 1113. Beide Verbindungen werden aktiv in die Zellen transportiert, Asi(III) durch Aquaglyceroporine 14 und Asi(V) durch Phosphattransporter 15 (Abb. 3). Nachdem Asi(V) von der Zelle aufgenommen wurde, wird es zu Asi(III) reduziert. Die Ausschleusung der Arsenverbindungen aus der Zelle ist abhängig von der Zellart und erfolgt mittels einer sogenannten MRP1-Pumpe 16. Im Körper wird Arsen an Globulin gebunden und über das Blut in die einzelnen Organe verteilt. Arsenverbindungen können in der Haut und im Gewebe akkumuliert und über die Harnblase und den Gastrointestinaltrakt wieder ausgeschieden werden (Abb. 3).
Eigene Untersuchungen zur Aufnahmekapazität von Arsenverbindungen durch verschiedene Zellarten haben gezeigt, dass nichtmethylierende Zellen wie Fibroblasten oder Urothelzellen Arsenverbindungen effektiver aufnehmen als methylierende Zellen wie Hepatozyten (Abb. 4). Die Leberzellen verfügen über einen aktiven Ausschleusungsmechanismus, und es kann angenommen werden, dass arsenspezifische Exporterproteine (MRP13, multidrug resistance-associated proteins) die Arsenausschleusung bedingen 17. Die besonders hohen Aufnahmekapazitäten von Fibroblasten und Urothelzellen für Arsenverbindungen könnten in ursächlichem Zusammenhang mit dem vermehrten Auftreten von malignen Hautveränderungen und Harnblasenkrebs stehen.
Untersuchungen zur subzellulären Verteilung der Arsenverbindungen haben gezeigt, dass vor allem der Zellkern und die Ribosomen Arsenverbindungen aufnehmen (Abb. 5, 18). Eine Korrelation zwischen diesen Ergebnissen und den in früheren Studien nachgewiesenen gentoxischen Effekten ist ableitbar 1113. Es wird vermutet, dass auch die Eiweißsynthese, die in den Ribosomen stattfindet, durch Arsenverbindungen beeinflusst werden kann. Verstärkte Forschungsarbeit hierzu ist jedoch noch notwendig.
Trotz der geringeren Arsen-Aufnahme durch Hepatozyten (Abb. 4) sind die Leberzellen empfindlicher gegenüber einer Arsenexposition als die Urothelzellen, wie die signifikant erhöhte TBARS-Bildung (Thiobarbitursäure-reaktive Substanzen, indirekter Nachweis für die Bildung freier Radikale) zeigt (Abb. 6, 19). Auch hier sind weitere Untersuchungen zur Untermauerung der ersten Befunde notwendig. Vergleichende Studien zur arseninduzierten Gentoxizität in primären Hepatozyten und in primären Urothelzellen sind derzeit in Arbeit.
Ein weiterer wichtiger Modulator für viele physiologische und pathologische Prozesse innerhalb der Zelle ist der intrazelluläre Calciumspiegel [(Ca2+)i]. Eine Änderung des [Ca2+]i kann die Genexpression, die Signaltransduktion und auch die Apoptoseinduktion beeinflussen. Arsenverbindungen sind in der Lage, eine kurzzeitige Änderung des [Ca2+]i hervorzurufen. Ein rapider Abfall des intrazellulären Calciumspiegels wurde bereits wenige Sekunden nach Applikation von Arsenverbindungen beobachtet 20. Inwiefern diese beobachteten arseninduzierten Calciumveränderungen Auswirkungen auf zelluläre Vorgänge haben, muss ebenfalls weiter untersucht werden.
3. Biomethylierung ist keine Detoxifizierung
Die Methylierung des Arsens findet hauptsächlich in der Leber unter Beteiligung von Methyldonoren [S-Adenosylmethionin (SAM), Glutathion (GSH)] statt. Für diesen Vorgang werden zwei mögliche Mechanismen diskutiert. Der allgemein akzeptierte und vielfach zitierte Weg nach Challenger 21 beschreibt die Biotransformation der anorganischen Spezies Asi(V) und Asi(III) zu mono-, di- und trimethylierten Verbindungen (Abb. 7). Dabei finden vielfältige Reduktions- und Oxidationsprozesse statt. In den Reaktionen des Challenger-Mechanismus werden die fünfwertigen methylierten Arsenspezies vor den dreiwertigen Analogen gebildet. Dieser Mechanismus erklärt jedoch nicht den Fakt, dass der Hauptmetabolit im Urin DMA(V) ist und mit einem Anteil von 5080% vorliegt (gefolgt von MMA(V) und den anorganischen Arsenverbindungen) 22,23.
Der von Hayakawa et al. 24 vorgeschlagene Mechanismus scheint diese aufgeworfene Fragestellung besser zu beantworten. Bei dem Hayakawa-Mechanismus werden die dreiwertigen methylierten Arsenspezies vor den fünfwertigen Spezies gebildet, die dann als Endprodukte des Arsenmetabolismus ausgeschieden werden (Abb. 8).
Interessanterweise werden die dreiwertigen methylierten Arsenverbindungen als Ausscheidungsprodukte im Urin nicht oder kaum detektiert 22. Die Gründe hierfür sind nur spekulativ und nicht eindeutig belegbar. Einige Autoren diskutieren, dass MMA(III) und DMA(III) eine starke Affinität zu Thiolgruppen und vicinalen Dithiolen haben und somit fest an Proteine gebunden sind und erklären damit deren hohe Toxizität 23. Dies erscheint jedoch nicht einleuchtend, da gerade diese beiden Verbindungen am besten membranpermeabel sind und in den höchsten Konzentrationen intrazellulär vorliegen 12,13. Unbestritten ist dagegen die Tatsache, dass die methylierten dreiwertigen Verbindungen eine besonders hohe Toxizität aufweisen 12,13,23,2530. Die Biomethylierung des Arsens kann daher nicht mehr als reiner Detoxifizierungsprozess angesehen werden.
4. Sauerstoffradikale spielen eine bedeutende Rolle beim arseninduzierten zellulären Schädigungsmechanismus
Arsenverbindungen sind in der Lage, oxidativen Stress in der Zelle zu induzieren. Ein wichtiges Radikal, das gebildet wird, ist Hydrogenperoxid. Dies hat vielfältige Funktionen innerhalb der Zelle. Es kann die Strukturen der DNA, der RNA und der Proteine schädigen, jedoch hat es auch eine bedeutende Signalfunktion, indem es mit Thiolen reagieren kann und somit Signalwege an- oder ausschaltet. Der allgemein akzeptierte Mechanismus der Arsen-Toxizität besteht in der Reaktion des Arsens mit den Thiolen, speziell mit den vicinalen Thiolen der Enzyme, was zu einer Hemmung der katalytischen Aktivität führt 31. Eines der meist untersuchten Enzymmodelle in diesem Zusammenhang ist der Pyruvatdehydrogenase (PDH)-Komplex. Es wird angenommen, dass Arsenit den PDH-Komplex inhibiert 32. Untersuchungen von Samikkannu et al. 33 haben gezeigt, dass Arsenit eine erhöhte Freisetzung von Hydrogenperoxid induziert. Das führt wiederum zur oxidativen Zellschädigung und zu einer Inaktivierung des PDH Proteins.
Ein indirekter Nachweis zur Bildung freier Radikale (insbesondere Hydrogenperoxid) ist die Bestimmung von Malondialdehyd nach Reaktion mit 2-Thiobarbitursäure. Die Bildung von Thiobarbitursäure-reaktiven Substanzen (TBARS) gilt als Indikator für die durch Peroxidradikale veränderten Lipide der Zellmembran (Lipidperoxidation). Dieser indirekte Radikalnachweis wurde auch nach Arsenexposition in verschiedenen Zellsystemen angewendet und hat gezeigt, dass Arsenverbindungen oxidativen Stress hervorrufen 34. Die Höhe der gebildeten TBARS nach Arsenexposition variiert in Abhängigkeit von der Zellart, der Spezies und der Expositionsdauer (Abb. 6).
5. Die mutagene/kanzerogene Wirkung des Arsens scheint hauptsächlich auf indirekten zellulären Effekten zu beruhen
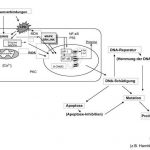
Drei Mechanismen der kanzerogenen Wirkung von Arsenverbindungen wurden in den letzten Jahren verstärkt diskutiert: (1) die Induktion von oxidativem Stress (siehe Punkt 4), (2) die Wechselwirkungen mit DNA-Reparaturprozessen und (3) die Veränderungen der Genexpression 27,28. Weiterhin diskutiert werden epigenetische Wirkmechanismen nach Arsenexposition und die Aktivierung spezieller Signaltransduktionswege, die zu einer veränderten Genexpression führen 47 (Abb. 9).
Bezüglich der gentoxischen Effekte durch oxidativen Stress belegen einige neuere Studien die Induktion von DNA-Strangbrüchen, DNA-Protein-Vernetzungen und oxidativen DNA-Basenmodifikationen im niedrigen mikromolaren 29,30 oder sogar nanomolaren 25 Konzentrationsbereich von Arsenit, der am besten untersuchten Verbindung des Arsens.
Darüber hinaus wurden mutagenitätsverstärkende Effekte sowie eine Hemmung sowohl der Basen-Exzisionsreparatur (BER) als auch der Nucleotid-Exzisionsreparatur (NER) in der Literatur beschrieben 27. Im Gegensatz zu den dreiwertigen methylierten Metaboliten zeigen die fünfwertigen Verbindungen gentoxische Effekte erst in wesentlich höheren Konzentrationen. Dies konnte zum einen auf die verminderte Aufnahme in Zellen zurückgeführt werden 13, zum anderen waren aber auch deutliche Unterschiede in subzellulären Testsystemen erkennbar: so wurde Zink aus der isolierten Zinkfingerdomäne des XPA-Proteins (notwendig zur DNA-Reparatur) in Gegenwart von dreiwertigen, nicht aber von fünfwertigen Arsenverbindungen freigesetzt 35. Die DNA-Reparatur scheint somit von dreiwertigen Arsenverbindungen stärker gehemmt zu werden als von den fünfwertigen Verbindungen. Die Hemmung der DNA-Reparatur durch Modifizierung von DNA-Reparaturproteinen scheint ein wesentlicher Mechanismus der Arsen-induzierten Kanzerogenese zu sein 46,47.
In Versuchen von Rea et al. 42 wurde gezeigt, dass Arsen eine globale Veränderung der Genexpression in humanen Keratinozyten bewirkt. Mikroarray-Daten von verschiedenen Gruppen belegen eine Änderung der Expressionsprofile von immortalisierten humanen Urothelzellen der Urethra nach Arsenbehandlung 43. Dabei war auch eine Überexpression bestimmter Zytokeratine nachweisbar. Die Autoren schlussfolgerten, dass die Exposition von humanen (transformierten) Urothelzellen gegenüber Asi(III), MMA(III) oder DMA(III) in verschiedenen epigenetischen Effekten resultiert und die Aktivität von NF-kappa B unterdrückt ist.
Ein weiterer wichtiger epigenetischer Mechanismus der kanzerogenen Wirkung von Arsen ist die Veränderung der normalen DNA-Methylierungsmuster. Die Tumorbildung geht häufig mit einer globalen Hypomethylierung einher, die eine Aktivierung möglicher Onkogene und genomische Instabilität zur Folge haben kann, sowie einer regionalen Hypermethylierung, die zu einer Ausschaltung von bestimmten Tumorsuppressorgenen (p53, p16 44) führen kann.
Eine Veränderung der Genexpression kann zu Proteinmodifikationen führen. Lee et al. 45 untersuchten Veränderungen im Proteinmuster in humanen epidermalen Zellen nach Arsenexposition, fanden signifikante Unterschiede und folgerten, dass eine systematische Untersuchung der veränderten Expression von Proteinen in arsenexponierten Zellen von großer Bedeutung ist.
Die Affinität von Arsen zu SH-Gruppen führt zu einer Bindung von Arsen an verschiedene Strukturproteine wie Zytokeratine. Es gibt in diesem Zusammenhang Hinweise auf die Ausbildung Arsen-induzierter DNA-Protein crosslinks in Leberzellen, darunter auch crosslinks zwischen DNA und bestimmten Zytokeratinen, welche zu Mutationen und Strangbrüchen führen können 36. Weitere Bindungsstellen für Arsen finden sich in den SH-Gruppen der Spindelfaserproteine, was zu einer Beeinträchtigung der Prozesse während der Mitose führen kann. Weiterhin wird oxidativer Stress mit chromosomalen Schäden assoziiert [37]. Auch eine genomweite Hypomethylierung wird als Ursache einer Arsen-bedingten chromosomalen Instabilität in Verbindung gebracht 38.
Die chemische Affinität von Arsen zu Zytokeratinen ist meist von einer Zytokeratin-Überexpression begleitet, deren genaue Mechanismen noch unbekannt sind. Die Zytokeratin-Biosynthese ist eng mit dem Differenzierungsprogramm verschiedener epithelialer Zelltypen verbunden. So führen die Arsen-Effekte im Plattenepithel der Haut letztendlich zum Bild einer Hyperkeratose 39. Arsen-assoziierte Tumoren zeigen oft eine plattenepitheliale Differenzierung. Dies scheint aber nicht bei Arsen-induzierten Blasentumoren der Fall zu sein, da diese wie die meisten Tumoren der Harnblase überwiegend Übergangszell-Karzinome darstellen, während Plattenepithel-Karzinome hier deutlich seltener vorkommen 40,41. Interaktionen von UV-Strahlung und Arsenexposition scheinen das Risiko einer Induktion von Hautläsionen und Hautkrebs zu erhöhen. Verschiedene Studien haben gezeigt, dass die durch Arsen hervorgerufene Beeinflussung der DNA-Reparaturenzyme und -Proteine die Reparatur des UV-induzierten DNA-Schadens verzögert oder inhibiert 48,49,50.
6. Schlussfolgerungen
Sowohl die anorganischen als auch die organischen Arsenverbindungen unterliegen im Organismus einer Reihe von Oxidations- und Reduktionsprozessen sowie Methylierungsreaktionen, bei denen fünf- und dreiwertige methylierte und nichtmethylierte Arsenverbindungen gebildet werden. Die Reaktivität dieser Verbindungen ist sehr verschieden, wobei dreiwertiges Dimethylarsen die bisher nachgewiesene höchste Toxizität aufweist. Die Toxizität der Arsenspezies ist auch von deren Membrangängigkeit abhängig. Fünfwertige Arsenverbindungen sind weniger membranpermeabel und damit auch weniger toxisch als die dreiwertigen Verbindungen. Die Aufnahmekapazität für Arsen und dessen Metabolite ist ebenfalls stark zelltypabhängig. So können nichtmethylierende Zellen offensichtlich größere Arsenmengen aufnehmen als methylierende Zellen, die diese Verbindungen wieder aktiv ausschleusen. Die Zellschädigung durch Arsen scheint jedoch auch in den methylierenden Zellen erheblich zu sein, was in eigenen Versuchen am Beispiel der Radikalbildung in HepG2-Zellen gezeigt werden konnte 19. Eine Anreicherung der Arsenspezies in Zellorganellen wie dem Zellkern, den Ribosomen oder auch den Mitochondrien weist auf einen vielfältigen Wirkungscharakter des Arsens und seiner Derivate hin. In den eigenen Studien wurde gezeigt, dass hauptsächlich Dimethylarsen (III) nach 1 h Exposition im Zellkern nachweisbar ist. DMA(III) ist auch diejenige Arsenspezies, die die stärksten chromosomalen Veränderungen hervorruft, wie in früheren Studien gezeigt wurde 12,13.
Eine Exposition von Zellen gegenüber Arsenverbindungen ruft die Bildung freier Radikale wie NO, O2-, OH, ONOO- hervor, die Interaktionen mit den Targetmolekülen (Proteine, DNA, Enzyme) eingehen und durch den induzierten oxidativen Stress in der Zelle, Lipidperoxidation, DNA-Schädigung und Aktivierung von Signalkaskaden, die bei der Tumorbildung beteiligt sind, auslösen können 26. Indirekte Mechanismen der DNA-Schädigung wie beispielsweise eine Beeinflussung der DNA-Reparatur durch Modifizierung der DNA-Reparaturenzyme und -Proteine, DNA-Hypomethylierungen und Aktivierung/Inaktivierung von Signalkaskaden innerhalb der Zelle scheinen bei der arseninduzierten Kanzerogenese vorherrschend zu sein.
Zusammenfassend kann festgestellt werden, dass einerseits der Methylierungsgrad, der Oxidationsstatus und die Membrangängigkeit die Toxizität der Arsenverbindungen bestimmen, dass andererseits aber auch die Durchlässigkeit der Zellmembran für diese Verbindungen und die Methylierungskapazität der Zellspezies eine nicht zu unterschätzende Rolle spielen. Weiterführende Untersuchungen müssen zeigen, inwiefern die in den Zellorganellen gespeicherten Arsenverbindungen zelluläre Prozesse wie die Lipidperoxidation, den Enzymstoffwechsel oder die Proteinsynthese beeinflussen.
· 7. Literatur
· WHO (World Health Organization) Arsenic and arsenic compounds. IPCS (International Programme on Chemical Safety) Environmental Health Criteria 224, WHO, Genf, 2001
· National Research Council. Arsenic in Drinking Water. 2001 Update. National Academy Press, Washington, D.C., 2001
· DFG-Deutsche Forschungsgemeinschaft. Arsen und anorganische Arsenverbindungen. In: Gesundheitsschädliche Arbeitsstoffe: toxikologisch-arbeitsmedizinische Begründungen von MAK-Werten (Greim H., ed), 35. Ausgabe, 2000
· EC (European Commission DG Environment) Ambient air pollution by As, Cd, and Ni compounds. Working Group on Arsenic, Cadmium and Nickel Compounds, Brüssel, Belgium, 2000
· ATSDR (Agency for Toxic Substances and Disease Registry) Toxicological profile for arsenic. US Department of Health and Human Services, Atlanta, Georgia, 2000
· Chowdhury UK, Biswas BK, Chowdhury TR, Samanta G, Mandal BK, Basu GC, Chanda CR, Lodh D, Saha KC, Mukheriee SK, Roy S, Kabir S, Ouamruzzaman Q, Chakraborti D. Groundwater arsenic contamination in Bangladesh and West Bengal, India. Environ Health Perspect 2000, 108: 393397
· ACGIH (American Conference of Governmental Industrial Hygienists) Arsenic and inorganic compounds. In: Documentation of TLVs and BEIs, ACGIH, Cincinnati, OH, USA, 1999
· EPA (Environmental Protection Agency) Arsenic in drinking water. National Academic Press, Washington DC, 2001
· IARC (International Agency for Research on Cancer) Arsenic and Arsenic Compounds (Group 1). IARC monographs, Suppl. 7, 1987, 100107
· IARC (International Agency for Research on Cancer) Arsenic and arsenic compounds. IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans, Band 23, IARC Lyon, 1980, 39141
· Styblo M, Del Razo LM, Vega L, Germolec DR, LeCluyse EL, Hamil GA, Reed W, Wang C, Cullen WR, Thomas DJ. Comparative toxicity of trivalent and pentavalent inorganic and methylated arsenicals in rat and human cells. Arch Toxicol 2000, 74: 289299
· Dopp E, Hartmann LM, Florea AM, von Recklinghausen U, Piper R, Shokouhi B, Rettenmeier AW, Hirner AV, Obe G. Uptake of trivalent and pentavalent inorganic and methylated arsenicals and association with cytotoxic and genotoxic effects in Chinese hamster ovary (CHO) cells. Toxicol Appl Pharmacol 2004, 201: 156165
· Dopp E, Hartmann LM, von Recklinghausen U, Florea AM, Rabieh S, Zimmermann U, Shokouhi B, Yadav S, Hirner AV, Rettenmeier AW. Forced uptake of trivalent and pentavalent methylated and inorganic arsenic and its cyto-/genotoxicity in fibroblasts and hepatoma cells. Toxicol Sci 2005, 87: 4656
· Liu Z, Shen J, Carbrey JM, Mukhopadhyay R, Agre P, Rosen BP. Arsenite transport by mammalian aquaglyceroporins AQP7 and AQP9. Proc Natl Acad Sci USA 2002, 99: 60536058
· Huang RN, Lee TC. Cellular uptake of trivalent arsenite and pentavalent arsenate in KB cells cultured in phosphate-free medium. Toxicol Appl Pharmacol 1996, 136: 243249.
· Salerno M, Petroutsa M, Garnier-Suillerot A. The MRP1-mediated effluxes of arsenic and antimony do not require arsenic-glutathione and antimony-glutathione complex formation. J Bioenerg Biomembr 2002, 34: 135145
· Lee TC, Ho IC, Lu WJ, Huang JD. Enhanced expression of multidrug resistance-associated protein 2 and reduced expression of aquaglyceroporin 3 in an arsenic-resistant human cell line. J Biol Chem 2006, 281: 18011807
· Dopp E. Neue Aspekte zur arseninduzierten Kanzerogenese. In: Wrbitzky R, Bader M (Hrsg.). Arbeitsmedizin in Landwirtschaft, Gartenbau und Forstwirtschaft. Dokumentationsband der DGAUM, 46. Jahrestagung Hannover; 2006, 125128
· von Recklinghausen U, Zimmermann U, Hartmann LM, Rabieh S, Hirner AV, Rettenmeier AW, Dopp E. Aufnahme und Toxizität von Arsenverbindungen in humanen Leber- und Urothelzellen. In: Wrbitzky R, Bader M (Hrsg.). Arbeitsmedizin in Landwirtschaft, Gartenbau und Forstwirtschaft. Dokumentationsband der DGAUM; 46. Jahrestagung Hannover; 2006, 610612
· Florea AM, Yamoah EN, Dopp E. Intracellular calcium disturbances induced by arsenic and its methylated derivatives in relation to genomic damage and apoptosis induction: a mini-review. Environm Health Perspect 2005, 113: 659664
· Challenger F. Biological methylation. Chemical Reviews 1945, 36: 315361
· Aposhian HV, Aposhian MM. Arsenic toxicology: five questions. Chem Res Toxicol 2006, 19: 115
· Sur R, Hajimiragha H, Begerow J, Dunemann L. Arsenmetabolismus im Menschen. Chem Unserer Zeit 2003, 37: 248256
· Hayakawa T, Kobayashi Y, Cui X, Hirano S. A new metabolic pathway of arsenite: Arsenic-glutathione complexes are substrates for human arsenic methyltransferase Cyt 19. Arch Toxicol 2005, 79: 183191
· Schwerdtle T, Walter I, Mackiw I, Hartwig A. Induction of oxidative DNA damage by arsenite and its trivalent and pentavalent methylated metabolites in cultured human cells and isolated DNA. Carcinogenesis 2003, 24: 967974
· Shi H, Shi X, Liu KJ. Oxidative mechanism of arsenic toxicity and carcinogenesis. Mol Cell Biochem 2004, 255: 6778
· Gebel TW. Genotoxicity of arsenical compounds. Int J Hyg Environ Health 2001, 203: 249262
· Kitchin KT. Recent advances in arsenic carcinogenesis: modes of action, animal model systems, and methylated arsenic metabolites. Toxicol Appl Pharmacol 2001, 172: 249261
· Liu SX, Athar M, Lippai I, Waldren C, Hei TK. Induction of oxyradicals by arsenic: implication for mechanism of genotoxicity. Proc Natl Acad Sci U S A 2001, 98: 16431648
· Li D, Morimoto K, Takeshita T, Lu Y. Formamidopyrimidine-DNA glycosylase enhances arsenic-induced DNA strand breaks in PHA-stimulated and unstimulated human lymphocytes. Environ Health Perspect 2001, 109: 523526
· Aposhian HV. Biochemical toxicology of arsenic. In: Hodgson E, Bend JR, Philpot RM (Hrsg.): Reviews in Biochemical Toxicology. Elsevier Science Publishing Co., New York, 1989, 265299
· Adamson SR, Stevenson KJ. Inhibition of pyruvate dehydrogenase multienzyme complex from Escherichia coli with a bifunctional arsenoxide: Selective inactivation of lipoamide dehydrogenase. Biochem 1981, 20: 34183424
· Samikkannu T, Chen CH, Yih LH, Wang AS, Lin SY, Chen TC, Jan KY. Reactive oxygen species are involved in arsenic trioxide inhibition of pyruvat dehydrogenase activity. Chem Res Toxicol 2003, 16: 409414
· Kalia K, Narula GD, Kannan GM, Flora SJ. Effects of combined administration of captopril and DMSA on arsenite induced oxidative stress and blood and tissue arsenic concentration in rats. Comp. Biochem Physiol C Toxicol Pharmacol 2007, 144: 372379
· Hartwig A, Pelzer A, Asmuß M, Bürkle A. Very low concentrations of arsenite suppress poly(ADP-ribosyl)ation in mammalian cells. Int J Cancer 2003, 104: 1 6
· Ramirez P, Del Razo LM, Gutierrez-Ruiz MC, Gonsebatt ME. Arsenite induces DNA-protein crosslinks and cytokeratin expression in the WRL-68 human hepatic cell line. Carcinogenesis 2000, 21: 701706
· Kitchin KT, Ahmad S. Oxidative stress as a possible mode of action for arsenic carcinogenesis. Toxicol Lett 2003, 137: 313.
· Sciandrello G, Caradonna F, Mauro M, Barbata G. Arsenic-induced DNA hypomethylation affects chromosomal instability in mammalian cells. Carcinogenesis 2004, 25: 413417
· Centeno JA, Mullick FG, Martinez L, Page NP, Gibb H, Longfellow D, Thompson C, Ladich ER. Pathology related to chronic arsenic exposure. Environ Health Perspect 2002, 110: 883886
· Celis JE, Celis P, Ostergaard M, Basse B, Lauridsen JB, Ratz G, Rasmussen HH, Orntoft TF, Hein B, Wolf H, Celis A. Proteomics and immunohistochemistry define some of the steps involved in the squamous differentiation of the bladder transitional epithelium: a novel strategy for identifying metaplastic lesions. Cancer Res 1999, 59: 30033009
· Cohen SM, Shirai T, Steineck G. Epidemiology and etiology of premalignant and malignant urothelial changes. Scand J Urol Nephrol Suppl 2000, 105115
· Rea MA, Gregg JP, Qin Q, Phillips MA, Rice RH. Global alteration of gene expression in human keratinocytes by inorganic arsenic. Carcinogenesis 2003, 24: 747756
· Su PF, Hu YJ, Ho IC, Cheng YM, Lee TC. Distinct gene expression profiles in immortalized human urothelial cells exposed to inorganic arsenite and its methylated trivalent metabolites. Environ Health Perspect 2006, 114: 394403
· Chanda S, Dasgupta UB, Guhamazumder D, Gupta M, Chaudhuri U, Lahiri S, Das S, Ghosh N, Chatterjee D. DNA hypermethylation of promoter of gene p53 and p16 in arsenic-exposed people with and without malignancy. Toxicol Sci 2006, 89: 431437
· Lee C, Lee YM, Rice RH. Human epidermal cell protein responses to arsenite treatment in culture. Chem Biol Interact 2005, 155: 4354
· Walter I, Schwerdtle T, Thuy C, Parsons JL, Dianov GL, Hartwig A. Impact of arsenite and its methylated metabolites on PARP-1 activity, PARP-1 gene expression and poly(ADP-ribosyl)ation in cultured human cells. DNA Repair 2007, 6: 6170
· Huang C, Ke Q, Costa M, Shi X. Molecular mechanisms of arsenic carcinogenesis. Mol Cell Biochem 2004, 255: 5766
· Danaee H, Nelson HH, Liber H, Little JB, Kelsey KT. Low dose exposure to sodium arsenite synergistically interacts with UV radiation to induce mutations and alter DNA repair in human cells. Mutagenesis 2004, 19: 143148
· Rossman TG, Uddin AN, Burns FJ. Evidence that arsenite acts as a cocarcinogen in skin cancer. Toxicol Appl Pharmacol 2004, 198: 394404
· Yu HS, Liao WT, Chai CY. Arsenic carcinogenesis in the skin. J Biomed Sci 2006, 13: 657666
Dopp E. Institut für Hygiene und Arbeitsmedizin, Universitätsklinikum Essen